
点击右上角![]() 微信好友
微信好友
 朋友圈
朋友圈

请使用浏览器分享功能进行分享

CAR-T细胞疗法是近年来癌症治疗领域的重大突破之一。迄今为止,美国FDA已经批准了5款CAR-T疗法,用于治疗多种类型的血液癌症。然而,在治疗实体瘤方面,目前仍然没有任何获批的CAR-T疗法。近日,Nature Reviews Drug Discovery发表了一篇综述,对CAR-T疗法治疗实体瘤遇到的挑战和解决策略进行了深度分析。笔者结合公开资料,介绍这一综述的精彩内容。
选择CAR-T细胞疗法合适的靶标
对于CAR-T疗法来说,合适的靶标是决定它们的疗效和安全性的主要原因。因为CAR-T细胞表面表达的嵌合抗原受体(CAR)会将细胞引导到表达靶标抗原的细胞,如果这些靶标表达在健康组织上,那么CAR-T疗法即使与正确的靶标结合,也可能因为杀伤健康细胞而产生强烈的毒副作用。
目前治疗血液癌症的获批CAR-T疗法都是在靶向B淋巴细胞上的特异性抗原(例如CD19和B细胞成熟抗原),而这些疗法一个常见的副作用是导致健康B细胞的清除,不过它们仍具有可以接受的安全性。
而在治疗实体瘤方面,找到一个只在肿瘤中表达而不在健康组织中表达的特异性靶标十分困难。Nature Reviews Drug Discovery的综述文章中指出,靶向多个不同靶标的CAR-T疗法在临床试验中出现过严重的毒副作用。
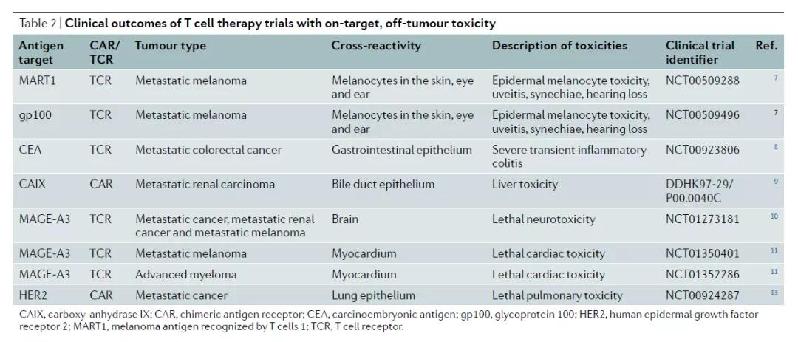
图片:CAR-T疗法在临床试验中出现过因为与非肿瘤组织表达的靶标结合产生的毒副作用)
因此,在治疗实体瘤时,选择一个更具特异性的靶点至关重要。目前在治疗实体瘤方面,在研细胞疗法靶向的“热门”靶标包括HER2、EGFR、间皮素(mesothelin)、NY-ESO-1、PSMA等等。其中NY-ESO-1属于癌症睾丸抗原(CTA),它通常只在睾丸或卵巢组织中表达,然而在多种癌症中,这种抗原会重新开始表达。因此,它为T细胞疗法提供了一种特异性强而毒副作用弱的靶标抗原。
提高CAR-T疗法特异性的另一个方法是对CAR-T细胞表达的受体进行改造,从而增强它们识别肿瘤细胞的能力。例如,近日登上Science Translational Medicine封面的一项研究中,美国加州大学旧金山分校(UCSF)的研究人员设计了一种“智能”CAR-T细胞。利用称为synNotch的基因表达调控系统,先引导CAR-T细胞识别在部分癌细胞中高度特异性表达的EGFRvIII,然后激发识别EphA2或IL13Rα2的CAR的表达。这两种蛋白在所有癌细胞中都表达,从而可以指挥T细胞消灭所有的癌细胞。虽然EphA2或IL13Rα2也在部分健康细胞中表达,但由于在synNotch系统的调节下,识别它们的CAR只会在迁移到肿瘤中的T细胞上表达,因此健康细胞不会受到这些CAR-T细胞的攻击。
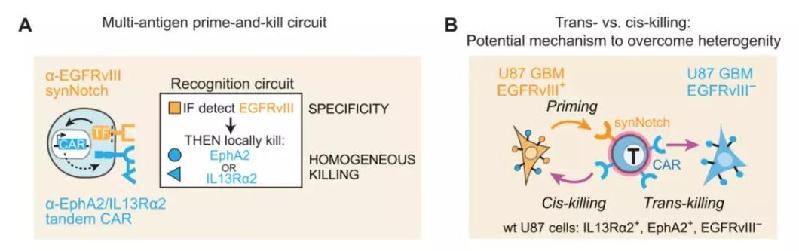
图片:智能CAR-T细胞疗法的设计和作用机理,通过与特异性抗原结合的synNotch系统调节识别周围癌细胞的CAR的表达)
这个设计同时可能解决CAR-T治疗实体瘤时的另一个挑战,那就是实体瘤由于它的异质性,并不是所有细胞都会表达CAR-T疗法靶向的靶标。SynNotch系统产生的作用被称为“旁观者效应”(bystander effect),是指让CAR-T细胞在特异性地到达肿瘤后,能够杀伤周围不表达特异性靶标的肿瘤细胞,从而增强杀伤效果。在小鼠模型中,利用synNotch系统设计的“智能”CAR-T疗法也确实显示出了更好的效果。
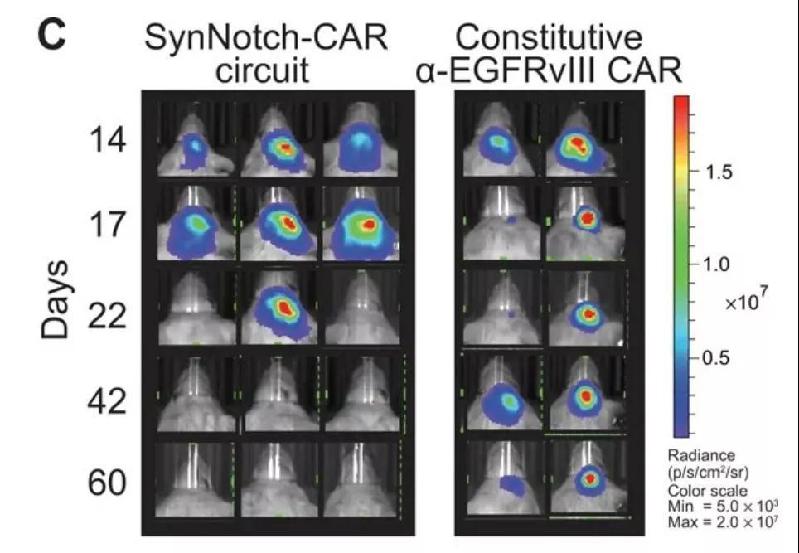
图片:在小鼠肿瘤模型中,植入了synNotch系统的CAR-T细胞(左图)表现出更强的抗癌能力)
除了synNotch系统以外,科学家们还设计了多种其他的“分子开关”,它们的作用包括让CAR-T细胞能够识别多种不同的抗原;在识别健康细胞表达的抗原后失活;或者可以通过药物调控CAR-T细胞的活性。这些对CAR-T细胞的改造都有助于提高它们治疗实体瘤时的特异性并降低毒副作用。
克服肿瘤微环境的免疫抑制
实体瘤与血液癌症相比,一个重要的不同点是实体瘤周围形成的肿瘤微环境(TME)。TME中包含着多种具有免疫抑制能力的细胞,例如调节性T细胞(Treg)、肿瘤相关巨噬细胞(TAM)等。TME中还过度表达TGFβ、IL-10、IL-4等具有免疫抑制能力的细胞因子。这些因素构成的免疫抑制环境能够显著降低CAR-T细胞的效力。
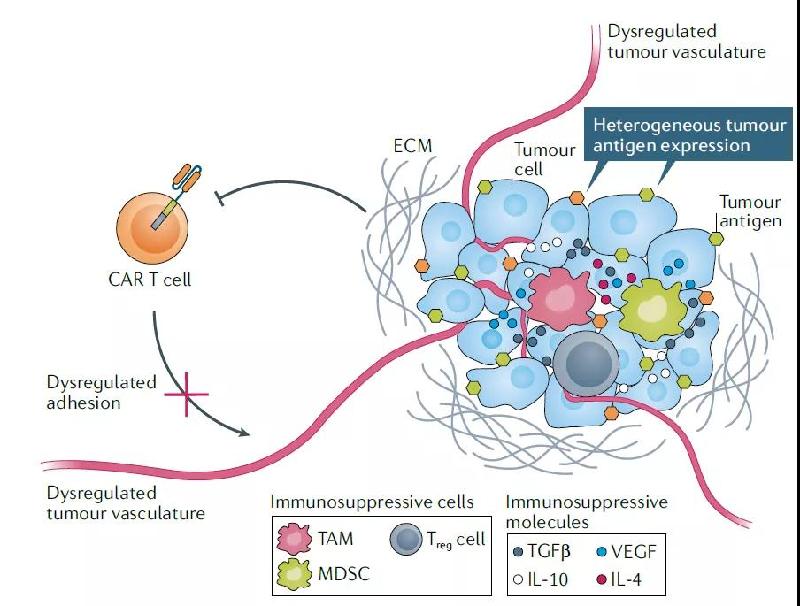
图片:实体瘤的肿瘤微环境中可能影响CAR-T细胞效力的多种因素)
为了克服TME的影响,科学家们给新一代的CAR-T疗法加上了对抗免疫抑制的“武器”。这些“武装起来的CAR-T细胞”(armored CAR-T cells)正在成为T细胞疗法开发的一个趋势。
科学家们为CAR-T细胞添加的“武器”多种多样。例如,一个对抗TGFβ免疫抑制功能的方法是在CAR-T细胞中表达能够阻断TGFβ信号传导的显性负性受体(dominant negative receptor,DNR)。这种DNR能够与细胞中本来存在的TGFβ受体竞争和TGFβ结合,但是与TGFβ结合后不会引发下一步的信号传导。由著名CAR-T疗法先驱Carl June博士联合创建的Tmunity公司开发的一款新一代CAR-T疗法就采用了表达阻断TGFβ信号通路的DNR的策略。这款靶向PSMA的CAR-T疗法在治疗前列腺癌患者的临床试验中表现出了临床活性。这一策略也可以用于阻断PD-1介导的免疫抑制信号通路。
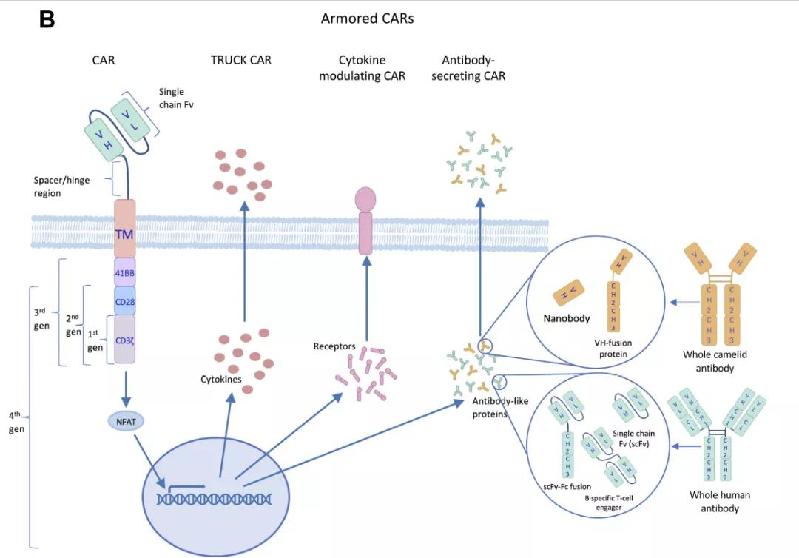
图片:“武装”CAR-T疗法的多种策略)
另一种对抗肿瘤微环境的方法是让CAR-T细胞同时表达能够改变肿瘤微环境特征的促炎症细胞因子,例如IL-12,IL-18和IL-23。IL-12和IL-18能够提高促炎症的细胞因子IFN-γ的分泌,而IFN-γ则能够进一步促进巨噬细胞释放IL-12,从而产生一个正反馈回路。以往的研究结果显示,全身性使用IL-12和IL-18均会导致很强的毒性,如果CAR-T细胞持续表达这些因子可能也会产生毒性,因此目前的设计是让CAR-T细胞在与靶标结合之后驱动细胞因子的表达,从而将细胞因子的作用限制在肿瘤附近。
CRISPR基因编辑技术的普及也为改造CAR-T细胞疗法提供了一种新的工具,Tmunity公司利用基因编辑敲除T细胞中的内源T细胞受体(TCR)和PD-1受体,然后再表达靶向NY-ESO-1抗原的TCR。利用这一技术开发的TCR细胞疗法已经在临床试验中表现出积极的疗效。CRISPR基因编辑技术不但有可能帮助消除可能影响T细胞疗法功能的基因,而且可以作为筛选工具,发现目前未知的全新T细胞功能调控因子。
目前,科学家拥有多种调节CAR-T疗法特性的工具,对它们的特异性、可控性、安全性、以及效力做出改进。利用最新的前沿技术对CAR-T疗法的多方面改进有望克服治疗实体瘤需要面对的多重障碍。另一方面,在CAR-T细胞疗法以外,科学家们也在开发其他形式的免疫细胞疗法,包括可以识别肿瘤细胞内抗原的TCR细胞疗法、利用先天免疫细胞的CAR-M疗法。Iovance biotherapeutics公司开发肿瘤浸润淋巴细胞(TIL)疗法在治疗晚期宫颈癌和黑色素瘤患者的关键性临床试验中也已经表现出积极的疗效。
参考资料:
[1] Hou et al. (2021). Navigating CAR- T cells through the solid- tumour microenvironment. Nature Reviews Drug Discovery, https://doi.org/10.1038/s41573-021-00189-2
[2] Researchers in biotech, academia and Big Pharma are offering puzzle pieces to crack CAR-T for solid tumors. Will they ever snap together? Retrieved May 25, 2021, from https://endpts.com/researchers-in-biotech-academia-and-big-pharma-are-offering-puzzle-pieces-to-crack-car-t-for-solid-tumors-will-they-ever-snap-together/
[3] Hawkins et al., (2021). Armored CAR T-Cells: The Next Chapter in T-Cell Cancer Immunotherapy. Biologics: Targets and Therapy, https://doi.org/10.2147/BTT.S291768
[4] Choe et al., (2021). SynNotch-CAR T cells overcome challenges of specificity, heterogeneity, and persistence in treating glioblastoma. Science Translational Medicine, DOI:10.1126/scitranslmed.abe7378
[5] Tmunity Corporate Presentation. Retrieved May 25, 2021, from https://ea68ab67-ef93-4814-a431-d4276b866a62.filesusr.com/ugd/233d22_2231a96a695e45deb71245baa7a7009d.pdf
