
点击右上角![]() 微信好友
微信好友
 朋友圈
朋友圈

请使用浏览器分享功能进行分享

上海证券交易所科创板公示显示:2021年3月16日,首药控股(北京)股份有限公司(以下简称“首药控股”或“公司“)向科创板递交首次公开发行股票申请(IPO)获受理。
2021年8月3日,科创板上市委2021年第53次审议会议,首药控股一次性顺利通过。从提交IPO申请,到审议通过。这家北京本土创新药企耗时不足5个月。
2022年2月8日,中国证监会发文按法定程序同意首药控股科创板首次公开发行股票注册。本次登陆科创板,拟募集资金20亿元资金,主要用于创新药项目研发与产业化基地建设等。本次IPO保荐机构(主承销商)为中信建投证券。
药融圈数据团队从首药控股(688197.SH)披露的招股意向书获悉:公司拟首次公开发行3718.00万股,占本次公开发行后总股本的25.00%。本次发行初步询价日期为2022年3月9日,网上路演时间为3月11日,申购日期为2022年3月14日。此次发行价格为39.90元/股。
首药控股的高效新药研发
低调的首药控股是一家处于临床研究阶段的本土小分子创新药企业,研发管线涵盖了非小细胞肺癌、淋巴瘤、肝细胞癌、胰腺癌、甲状腺癌、卵巢癌、 白血病等重点肿瘤适应症以及II型糖尿病等其他重要疾病领域。
研发为新药企业的根本:首药控股,目前形成集AIDD(AI药物设计)、药物化学、靶点生物学、药理学、药效学、药物代谢动力学、毒理学、药学研究、临床医学、转化医学研究、质量管理于一体的全流程创新药研发体系;这可能得益于公司从2010年开始精心布局深入研究小分子新药。
根据最新注册版的招股说明书:截止签署日,首药控股共有17个处于临床研究阶段的在研产品,其中6个自主研发产品,11个合作研发产品;此外还有多个临床前在研后续新药。
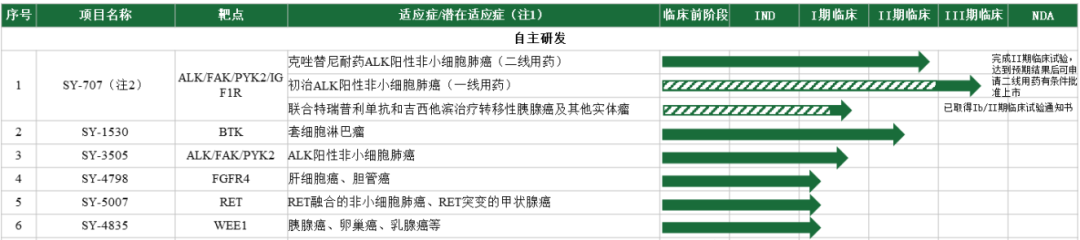
首药控股自主拥有的临床阶段pipeline
目前公司核心在研管线为SY-707、SY-1530(BTK)、SY-3505、SY-4798(FGFR4)、SY-5007 和SY-4835等六项已经处于临床研究阶段的自主研发产品,上述核心在研产品自药物发现、临床前研究至临床试验均由首药控股独立主导完成。Pipeline中候选药物靶点丰富、梯次分明。
01
药融云全球研发数据库(www.pharnexcloud.com)显示:首药控股是全球第二、国内目前披露的唯一覆盖ALK阳性非小细胞肺癌(NSCLC)全流程管理的药企,拥有二代和首个国产三代ALK抑制剂临床管线,致力于满足患者一线、二线、三线序贯治疗需求。此前CDE依据当时临床需求及沟通流程,同意SY-707在完成II 期临床试验,达到预期结果后可申请有条件批准上市(二线用药)。
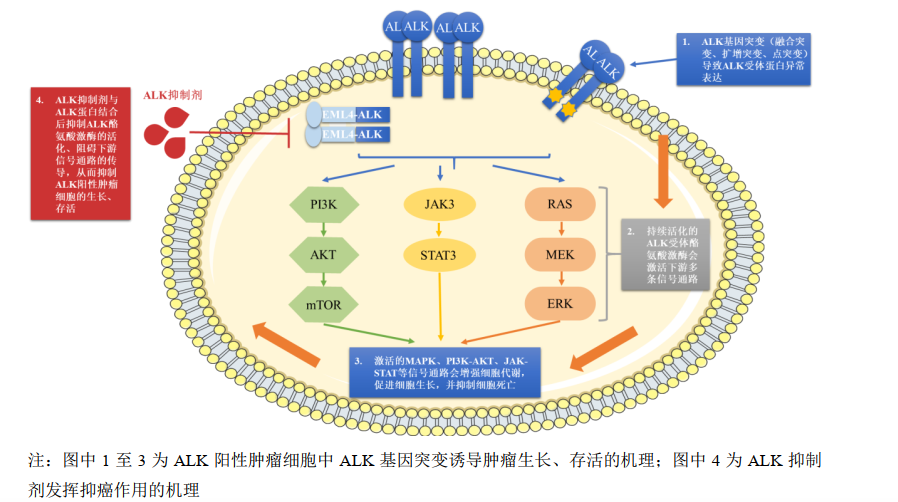
ALK抑制剂作用机理
全球范围内,目前已上市的一代ALK 抑制剂为克唑替尼,二代ALK 抑制剂包括塞瑞替尼、阿来替尼、布加替尼和恩沙替尼,三代ALK 抑制剂为劳拉替尼。SY-707与阿来替尼、塞瑞替尼、恩沙替尼针对克唑替尼耐药患者二线治疗的临床试验的主要疗效数据如下:
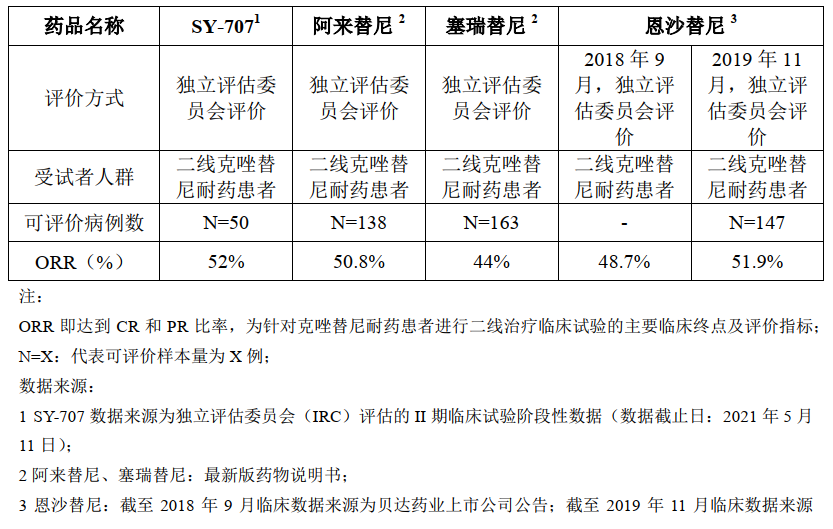
SY-707二线治疗适应症预计今年递交新药上市申请(NDA)
SY-707用于初治的ALK阳性非小细胞肺癌患者(一线治疗)的III 期临床试验于2020 年8月入组首例受试者,该临床试验的主要研究终点为经过独立影像评估的无进展生存期(PFS)。截至2021年12月31日,SY-707 III 期临床试验已完成入组。预计将于2023年递交新药上市申请(NDA)。
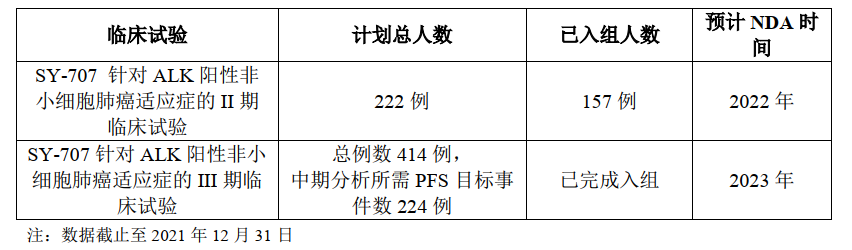

SY-707是一款ALK/FAK/PYK2/IGF1R多靶点抑制剂。临床前研究数据显示,在胰腺癌等未被满足的疑难癌症领域,有一定治疗潜力。2021年10月,SY-707联合特瑞普利单抗(PD-1)和吉西他滨治疗转移性胰腺癌及其他实体瘤的临床试验申请已获NMPA临床试验默示许可。
02
SY-3505作为第三代ALK抑制剂,可有效抑制野生型ALK激酶和几个关键耐药突变体(如F1174L、L1196M、G1202R、G1269S、R1275Q等)的激酶活性,阻断其信号传导通路,最终实现有效抑制突变型肿瘤生长的效果。随着ALK 抑制剂药物在临床中的大量应用,目前已经发现了多种对ALK抑制剂耐药的激酶区突变体如L1196M、G1202R、G1269A、F1174X、G1275Q等。一代ALK 抑制剂克唑替尼对L1196M、G1202R、G1269A、F1174X等突变体无效;二代ALK 抑制剂塞瑞替尼、阿来替尼和布加替尼均对G1202R突变体无效。因此,临床中亟待开发针对一代和二代ALK抑制剂耐药的第三代ALK抑制剂。
SY-3505正在进行单臂、开放、剂量爬坡的I 期临床研究,主要研究目的为在ALK 阳性非小细胞肺癌患者中考察SY-3505 胶囊的安全性及耐受性,确定剂量限制性毒性(DLT)、最大耐受剂量(MTD)及II 期临床推荐剂量(RP2D),牵头研究者为中国医学科学院肿瘤医院前副院长石远凯教授,共设11 个研究中心。SY-3505临床 I期计划入组50-70 例受试者。截止2021 年12 月31 日,本临床试验研究已入组32 例受试者,已完成剂量爬坡工作。
已有临床数据显示,多例经二代药物治疗后耐药的受试者已初见疗效,在人体试验(First-in-human)中初步体现了SY-3505作为三代药物的价值。
03
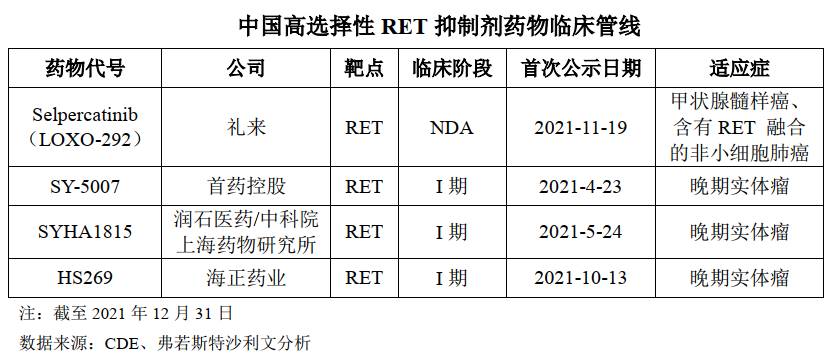
SY-5007 是第一款进入临床研究阶段的国产选择性RET 抑制剂,拟用于治疗RET阳性非小细胞肺癌及甲状腺癌,于2021年 4月进入I 期临床试验阶段。RET融合在非小细胞肺癌中的发生率约为2%,在乳头状甲状腺癌中的发生频率为10-20%。RET突变是甲状腺髓样癌(MTC)中常见的激活突变,50%的散发的甲状腺髓样癌和几乎全部的家族性的甲状腺髓样癌中都RET的突变。
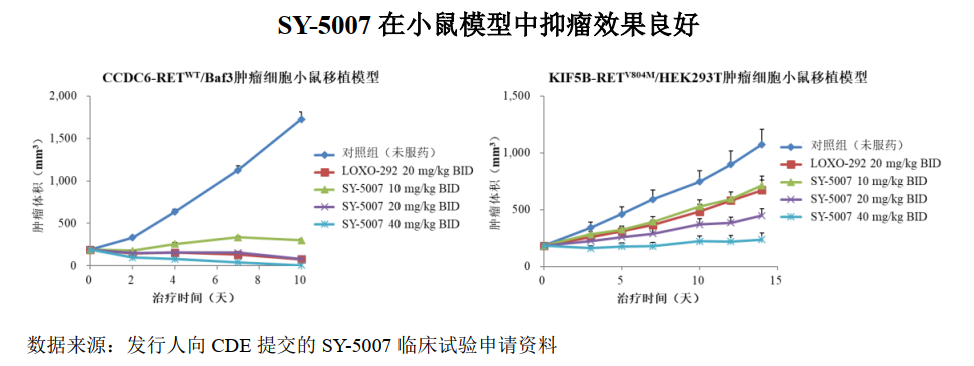
截至2021年12月末,国内仅有一款高选择性 RET抑制剂获批上市。基石药业拥Blueprint Medicines开发的普拉替尼单药或联合治疗在大中华地区(包括中国大陆、香港、澳门和台湾地区)的独家临床开发与商业化权利。
04
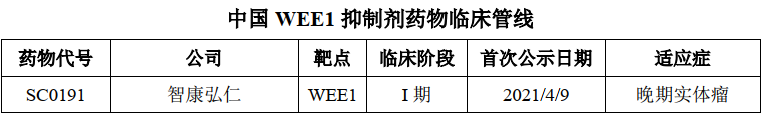
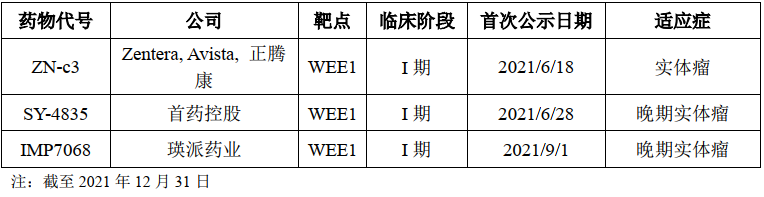
SY-4835是临床试验进度处于第一梯队的国产WEE1抑制剂候选药物。WEE1蛋白激酶是丝氨酸/苏氨酸蛋白激酶家族的一员,WEE1激酶是一种细胞周期调节蛋白。细胞依赖于WEE1或者p53等调节细胞周期的蛋白进行DNA损伤修复,如果WEE1和p53两条信号通路均受损,则细胞将死于无法修复的DNA损伤。临床前及临床试验已经证实抑制WEE1 蛋白的功能能够有效杀死p53 功能缺失的肿瘤细胞。WEE1在多种癌症类型中高表达,如卵巢癌、胰腺癌、黑色素瘤、乳腺癌、白血病、肝癌、宫颈癌、肺癌、鳞状细胞癌、恶性胶质瘤和成神经管细胞瘤等。
SY-4835拟用于治疗胰腺癌、卵巢癌、乳腺癌、肺癌等多种实体瘤,于2021年6月进入I 期临床研究阶段。目前,全球范围内尚无WEE1抑制剂获批上市。阿斯利康的AZD1775全球临床试验进展最快。
05
SY-1530 为全新结构的高选择性、不可逆的BTK 激酶抑制剂,拟用于治疗复发难治性非霍奇金淋巴瘤(NHL)等B 细胞来源的恶性肿瘤。目前已进入II 期临床研究阶段,用于治疗非霍奇金淋巴瘤中的套细胞淋巴瘤(MCL)。
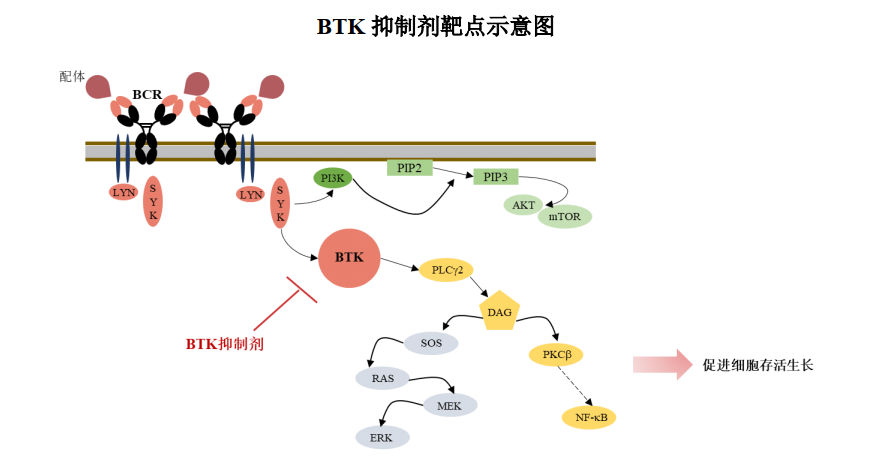
截至2021年12月31日,SY-1530临床进展和公开披露的临床数据如下:
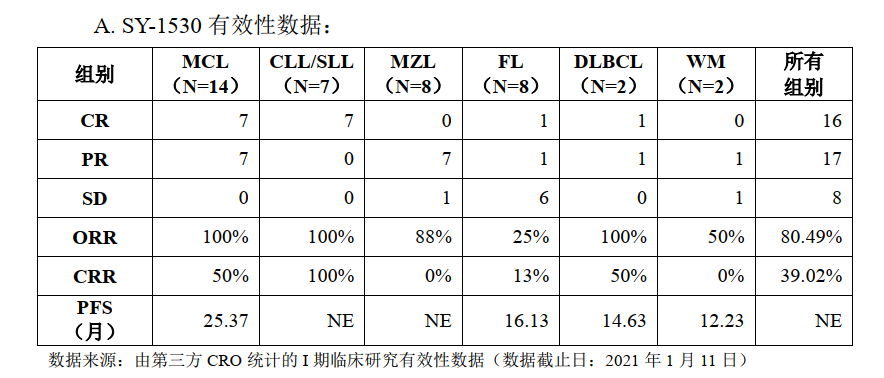
安全性方面:根据第三方CRO统计的I期临床研究安全性数据(数据截止日:2021年1月11日),41例受试者中共有33例(80.49%)发生药物相关不良反应,其中出现3-4级不良反应受试者占比较少。试验中未观察到一些同类靶向药物出现的致死性出血、心房颤动、第二原发性恶性肿瘤、肿瘤溶解综合征、胚胎-胎儿毒性等严重不良反应。
06
SY-4798 是一款高选择性、高活性、不可逆的小分子FGFR4抑制剂,具有新颖的化学分子结构;拟用于治疗肝细胞癌(HCC)、胆管癌等消化道肿瘤,已于2021年4月进入I期临床研究阶段。大约30%的肝细胞癌患者的肿瘤表达异常激活的FGFR4,其与配体FGF19 结合后传导信号。动物试验显示,FGF19过表达可促进转基因小鼠肝脏肿瘤的形成,抑制FGF19-FGFR4信号通路可阻断此过程。异常活跃的FGF19-FGFR4信号在人肝癌发生中有类似作用,是驱动肝细胞癌的发生并造成不良预后的关键因素之一。
药融云数据显示,目前高选择性FGFR4抑制剂在全球范围内均未有药物上市,存在未被满足的患者需求,同时几款同靶点候选新药品种均处于临床研究阶段。相比于泛FGFR抑制剂,高选择性FGFR4 抑制剂可以显著减少由于脱靶效应而导致的不良事件,如对FGFR1 和FGFR3 的抑制而导致的软组织矿化和高磷血症等。
07
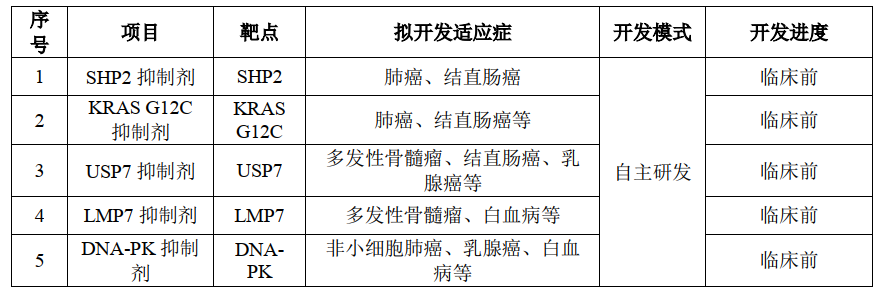
临床前候选新药pipeline(未包涵待披露靶点的3款)
招股书显示,首药控股多项候选新药的开发获得了国家“重大新药创制”专项的支持。
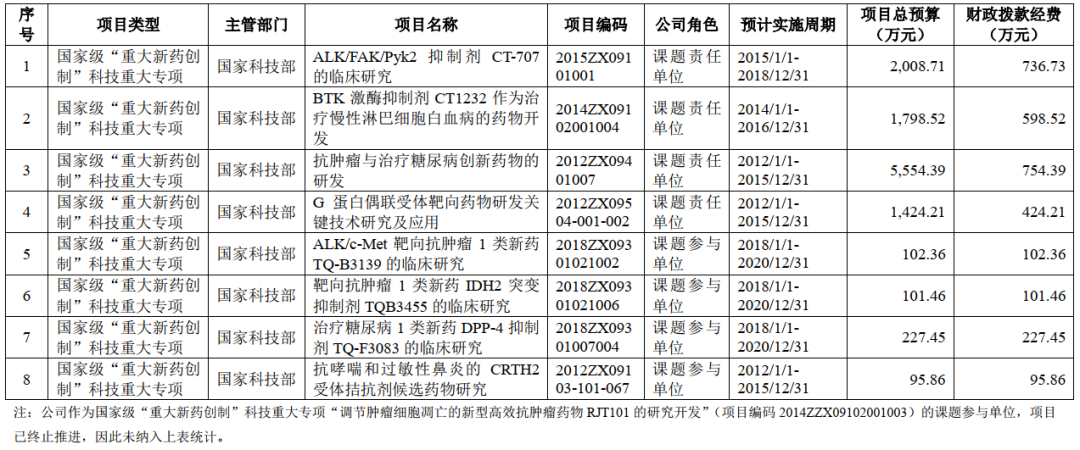
研发成本精细化运作
2018年度、2019年度、2020年度和2021年1-6 月,研发投入分别为3,183.65万元、4,391.03万元、8,503.27万元和6,561.51万元。报告期内,首药控股多数产品尚处于药品研发及临床研究早期阶段。
建立了全面、完善的新药研发体系,研发部门和团队覆盖了临床前及临床研究阶段的全部分工配置。临床前研发团队涵盖药物靶点验证、药物分子设计及结构优化、体内外药效综合评估、药物代谢动力学及毒理研究、合成放大工艺及分析制剂工艺开发等领域,以交替穿插、多线并行的研发模式替代传统单线循环的研究路径,大幅缩短研发周期、提高药物筛选的成功率,加速推进项目进程;通过不断加强临床团队建设,公司临床体系已实现从外部CRO为主转向公司内部控制为主的临床研究模式,整体临床推进速度明显提升。公司已实现全链条自主研发,对外部管线引进(license-in)的依赖度较低。
据悉,在首药控股投入新药研发的11年时间里,使用了6.7亿资金,申请发明专利367项,截止招股书签署日取得授权159项。
人才激励
新药研发,人才驱动:为研发人员创造宽松的研发环境,一定程度上促进新药研发效率。
目前,首药控股建立由核心研发团队组成的科学委员会,赋予核心研发团队研发决策权,发挥研发人员的主人翁精神及使命感;创造以人为本、有温度、有关怀的研发氛围,广泛争取各项人才福利政策和科技荣誉,让科技工作者能专注、专心于从事创新药研发。良好的研发氛围和创新机制有助于稳定核心研发团队,调动研发人员的积极性,提升公司的研发效率。
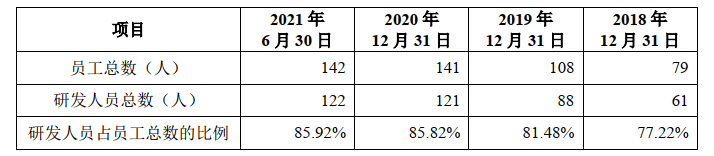
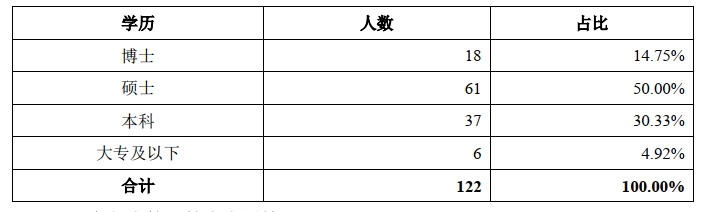
招股书签署日研发人员概况(目前有新增)
2020年度,首药控股实施了员工持股计划,确认的股份支付费用为24,281.76万元。相关股份支付费用计入管理费用。因此2020年报告期内公司净利润呈现亏损状态。万根线、诚则信是首药控股的两个员工持股平台,目前公司员工激励持股超50%,这在国内医药企业中是比较罕见的。在未来持续推出对核心员工股权激励。

注:上市前股权结构显示,目前首药控股外部股东有上市公司双鹭医药、北京政府财政资金亦庄国投、中信建投资本、华盖资本、领承创投、崇德英盛等。上一轮投后估值超50亿元人民币。
首药控股的对外输出:合作与授权
早年的新药license-out合作模式中:首药控股主要负责临床前候选药物的发现及筛选,在完成小试合成工艺交接后,与国内制药行业领军企业正大天晴药业集团或石药集团旗下石药中奇合作进行后续的GLP毒理实验、临床研发及商业化。合作研发模式下,首药控股与对方共同拥有合同项下的专利权、著作权等知识产权,未经一致同意,各方均不得向外部他方许可、转让项目相关的知识产权。在各方一致同意进行外部授权或转让情况下,双方需按一定比例分配取得收益。
2017年开始,首药控股开始聚焦自身发展,暂停对外研发合作,逐渐从Biotech向BioPharma转型。早期签订的合作研发合同,为首药控股公司争取到一定的现金流,支持稳健的进行候选新药开发储备。当然这类合作还有未来的产品销售权益分成,具体可参考注册版招股书中的细节。


具体而言,目前首药控股与正大天晴药业集团共合作11款候选新药项目,目前10款在临床研究阶段;1个项目为与石药中奇合作,目前在临床研究阶段。
合作开发pipeline进展

注:鉴于国家药审中心(CDE)2020年4月15日发布规定,“新修订的《药品管理法》实施(2019年12月1日)后提出的药品注册申请,不再受理两个和两个以上主体共同作为上市注册申请人的上市注册申请”, CT-1803、CT-2755、CT-3417、CT-3872、CT-4460项目根据协议约定由正大天晴和赛林泰共同具有知识产权,共同申报临床试验和新药上市,但临床试验实际申报方为正大天晴。公司仍可根据双方合同享有相关权益。
结 语
生物医药的创新,是一项非常繁琐庞大的工程,多学科、多部门、多人才的竞争。我国的生物医药创新起步比较晚;目前很多企业在共同努力。业内人士表示,创新药需要有其独特的临床价值,首先要解决未被满足的临床需求,也就是别人无药可医的急需,围绕这个目标的创新,做成功的药,那就是救命的药。对于病人和其家庭来说,就意味着所有的一切,所以,创新药的价值是不能单纯用价格价值来衡量的。(来源:药融圈)
